Detti interventi, eseguiti nell’arco di questi anni, dal Dott. Marco Scala e suoi collaboratori evidenziano gli effetti e l’efficacia della criochirurgia.
Facciamo notare che i sorprendenti risultati correlati alle basse temperature non sono ancora biologicamente conosciuti, cioè le ragioni biochimiche che sono le conseguenze dell’effetto criogenico dell’intervento, sono in fase di studio.
Membri della nostra equipe si stanno interessando a tali ricerche che verranno in seguito dettagliatamente descritte.
(Dott. Avalle)
(del Dott. Scala M.)
Generalità.
Sappiamo che la criochirurgia dermatologica è iniziata alle soglie del secolo scorso subendo una continua e progressiva evoluzione tuttora in fase d’incremento.[1] Lo sviluppo di tutte le scienze è sopportato da quelle collaterali che contribuiscono al suo ampliamento. Ciò accade inesorabilmente anche per quelle mediche. Nell’evoluzione scientifica e tecnologica, avvenuta nel corso degli anni, i progressi si basano sullo sviluppo di nuovi agenti criogenici, e di moderne strumentazioni da usare nel trattamento delle malattie della pelle, esse sono il frutto ottenuto nei laboratori di ricerca, e grazie all’esperienza clinica. Ciò ha dato alla criochirurgia un posto come preziosa ed efficace norma in chirurgia dermatologica [2]. La criochirurgia è un metodo versatile che è utilizzato per molte lesioni cutanee benigne, premaligne e maligne, (come avremo occasione di verificare nel seguito di questo capitolo) sia come forma primaria che scelta di trattamento [3]. La terapia ha come obiettivo di ridurre la temperatura della pelle sino a valori di molto inferiori allo zero, producendo così la distruzione localizzata del tessuto [4]. La guarigione della ferita avviene per seconda intenzione (e ne parleremo in seguito).
Facciamo notare che la parola "crioterapia" è spesso usata in modo intercambiabile con la criochirurgia, anche se con criochirurgia, chirurgia criogenica, crioablazione, o criocoagulazione sono descrizioni più accurate e specifiche delle moderne tecniche di congelamento dei tessuti per ottenere una ben definita risposta terapeutica. Gli studiosi di questa scienza attribuiscono l'origine del termine crioterapia al Professor Bordos nel 1912 e in seguito al dott. Giraudeau nel 1928. Sappiamo che nel 1930 Lortat-Jacobs e Solente [5] hanno pubblicato la monografia dal titolo "La Cryotherapie", nella quale sono descritti i diversi modi in cui sia il freddo che il congelamento hanno trovato uso e spazio in medicina, in particolare dermatologia e ginecologia.
La criochirurgia può essere un trattamento adatto per molte lesioni benigne e precancerose della cavità orale, nonché per pazienti selezionati con carcinoma a cellule squamose.
Sebbene l'uso della criochirurgia nella malattia orale sia ancora limitata, i suoi vantaggi possono modificare quest’atteggiamento e, nel prossimo futuro, è probabile che diventi un nuovo standard di trattamento per le seguenti ragioni:
- il facile accesso alla cavità orale per mezzo di diversi tipi di sonda;
- l'eventuale uso di una crema anestetica in applicazione topica;
- il trattamento di pazienti ad alto rischio - chirurgico e/o con deficit di coagulazione;
- il trattamento di ampie lesioni con maggiori possibilità di riabilitazione funzionale;
- un decorso postoperatorio relativamente indolore, con solo un lieve edema, che richiede un uso limitato di analgesico, e una morbida dieta che può essere assunta durante i primi giorni postoperatori;
- il controllo visivo diretto della crionecrosi nella zona d’intervento, e la possibilità di ripetere cicli di congelamento sulla malattia residua.
Gli usi terapeutici iniziali erano per gli interventi delle malattie della pelle, e nel 1899 il Dott. A. Campbell White [6] di New York, ha riferito l’uso delle basse temperature per il trattamento di nevi, verruche, ulcere varicose, bolle, pustole, herpes zoster, ed epiteliomi. Ha applicato l’aria liquida in forma di spray o per mezzo di un tampone immerso nel fluido criogenico. Pochi anni dopo, nel 1907, Whitehouse [7] descrisse l'utilizzo di un flacone spray di aria liquida, anche se ha trovato l'uso di questa tecnica difficile e smise di utilizzarlo a favore di un batuffolo di cotone. La sua esperienza include anche quindici casi di epiteliomi. Bowen e Towle [8] hanno concluso che l'aria liquefatta era un ottimo agente terapeutico, anche se poco pratico a causa della difficoltà di ottenerlo. Gold [9] in una relazione del 1910 incentrò sul suo utilizzo nell’epitelioma precoce, lupus eritematoso, vascolare nevi, e verruche. Tuttavia, si è fatta poco menzione dell'impiego di aria liquida dopo questi interventi.
Allo stesso tempo, l'impiego in chirurgia di neve di CO 2 (-78,5°C) fu favorito dal Dott. William Pusey, di Chicago, nonostante che era sostanzialmente più calda dell’aria liquida (circa -180°C). La CO 2 è stata tenuta allo stato liquido a una pressione di circa 800 psi. Il suo rilasciato in aria, con la conseguente diminuzione della pressione causa congelamento e formazione di una neve bianca che è raccolta in una sacca di camoscio (pelle). Il solido è poi compresso in forme appropriate, o bastoni, per essere in seguito applicata sulla pelle. La profondità del congelamento prodotto da questa tecnica era di circa 1-2 mm con un tempo di contatto di 10-30 secondi [10]. Nel libro di Basso furono descritte le varie tecniche per la formazione di bastoni di CO 2, il modo di martellare la neve in stampi, e le diverse tecniche per la formazione di questi strumenti. Detto libro fu pubblicato nel 1911 [11]. La CO 2 solida è stata l'agente criogenico più popolare agli inizi del 1900, e si è cercato, quindi, di elaborare strumenti per facilitarne il suo utilizzo, come ad esempio punte di rame o di sonde collegate a una sorgente di CO 2 o aria gelida forzata sotto pressione attraverso un tubo pieno di CO 2 solida [5,12,13].
Nel 1920, l'ossigeno liquido (-182,9°C) divenne disponibile in commercio, ma ottenne solo un uso limitato nel trattamento delle malattie della pelle. Abbiamo pochi riferimenti medici e riteniamo che il limitato utilizzo dell’ossigeno in sala operatoria risieda nella sua pericolosità, cioè nella sua facilità a esplodere e nel facilitare gli inneschi d’incendi.
Dopo la seconda guerra mondiale, i fluidi criogenici, in particolare ossigeno e azoto, divennero facilmente reperibili in commercio. Il loro utilizzo è stato rapidamente adottato in biologia e medicina per vari scopi. L'azoto liquido (-195,8°C), che non favorisce la combustione, è stato introdotto nella pratica clinica nel 1950 da Allington [14].
In questi anni Kurtin [15] si è servito di una bomboletta spray di cloruro di etile come agente anestetico durante la dermoabrasione. Tuttavia, studi sperimentali e clinici con cloruro di etile e i composti idrocarburici fluorurati hanno dimostrato che gli agenti non producevano congelamento più di 1-2 mm di profondità [16-18]. La loro utilità principale era come agente anestetico per la chirurgia superficiale.
Nel 1960 Hall [19] ha cercato di determinare quale tecnica avrebbe fornito risultati migliori. Brodthagen con trentadue esperimenti ha indagato la profondità del congelamento e la sua relazione con la pressione di applicazione. Anche con l'uso di pressione sul bastone CO 2, la profondità di distruzione era inferiore a 2 mm. Lo scambio di calore era meno efficace con la CO 2 che con l’azoto liquido, perché non vi era una differenza di temperatura efficace a favore di quest’ultimo.
In un interessante rapporto nel 1961 Grimmett ha descritto le limitazioni dell’applicatore intriso dell’azoto liquido, [20] egli ha studiato al microscopio la profondità di distruzione mediante biopsia diversi giorni dopo il congelamento ed ha verificato la limitata capacità di congelamento. E’ fisicamente riscontrato che la massa termica di un tampone intriso di azoto è limitata, e lo scambio di calore tra il tampone e il tessuto è scarso. Con queste tecniche non si apporta quello scambio termico desiderato al fine di ottenere la profondità di congelamento richiesta. Queste furono le ragioni che fecero della criochirurgia una norma terapeutica piuttosto irrilevante. Nel 1960, Zacarian e Adham [21, 22] hanno tentato di ottenere una maggiore profondità di penetrazione del tessuto attraverso l'utilizzo di dischi solidi di rame che sono stati raffreddati per immersione in azoto liquido prima dell'applicazione sulla pelle. I dischi di rame avevano una buona capacità termica ed elevate caratteristiche di scambio termico rispetto agli applicatori di cotone. Essi fornivano anche la possibilità di esercitare una pressione sulla lesione. Fu in tal modo ottenuta una distruzione tissutale a una profondità di 7 mm, fu certamente un miglioramento nella tecnica, ma il congelamento di grandi aree di tessuto, com’è necessario nel trattamento di neoplasie cutanee, non era ancora raggiunto.

Douglas Torre era anche un inventore esperto in termodinamica e fluidi criogeni. Ha usato gli apparecchi di Cooper per le malattie della pelle, ma li ha trovati troppo ingombranti e costosi per l'uso perciò li ha modificati. Nel 1988 il dott. Torre fu coautore di un libro con Lubritz Kuflik sugli aspetti pratici della criochirurgia [31].
Nel 1967 Setrag Zacarian descrisse un dispositivo simile di pari efficacia, ma quest’unità non conseguì il successo desiderato a causa delle sue dimensioni eccessive, del suo peso e delle lunghe linee di cavi [32]. Zacarian [18] ha pubblicato le sue ricerche e i dati clinici in una monografia nel 1969, e in seguito con altri due libri [33,34].
La via per lo sviluppo e il progresso della criochirurgia clinica era tracciata e la ricerca germogliava in diversi settori della medicina e dermatologia. Andrew Gage, noto chirurgo, ha intrapreso ricerche di laboratorio che hanno avuto importanti implicazioni per la criochirurgia cutanea. Nel 1965 Gage et al. [35] hanno dimostrato l'efficacia della crioterapia nel cancro orale. Gage [36] presentò le tecniche del trattamento del cancro del retto operabile con la crioterapia. E' stato anche un promotore per organizzare la Società di criochirurgia, l'American College of Cryosurgery, e per avvicinare i dermatologi con i medici di altre specialità per condividere la loro conoscenza della criochirurgia. Nel 1990 è coautore di un libro con Kuflik che prevedeva un riesame della criochirurgia e il trattamento del cancro della pelle criochirurgico [37].
Queste nuove norme di trattamento, indussero un numero di dermatologi negli Stati Uniti a iniziare e a includere la criochirurgia nelle loro pratiche per un’ampia varietà di lesioni. Furono organizzati seminari dermatocriochirurgici e centri di lavoro per diffondere le loro conoscenze.
Nel corso degli anni, Kuflik [38,39] ha mostrato il valore della criochirurgia per lesioni maligne difficili e grandi, verruche periungueali, e per quelle condizioni che non erano state in precedenza trattate con questa tecnica. Ha svolto, inoltre, attività di ricerca clinica, ha pubblicato numerosi articoli e capitoli, ed è coautore di due libri sulla criochirurgia [3,31,37,40]. Graham [41] ha aperto la strada all'uso della crioterapia per l'acne, e pubblicato numerosi articoli e capitoli. Lubritz [42] è stato decisivo nella creazione della crioterapia come forma primaria di trattamento per la cheratosi attinica, e co-autore di un libro sulla criochirurgia con Torre e Kuflik [31].
In quel periodo vi fu anche molto interesse per la criochirurgia dermatologica in altri paesi. Castro-Ron, a Caracas, Venezuela, pioniere della criochirurgia per il trattamento di emangiomi di grandi dimensioni, che mostra il suo valore nel trattamento del cancro della pelle di grandi dimensioni, e per l’attività palliativa. Egli viaggia molto per tenere conferenze ed è in gran parte responsabile per la formazione dell’Ibero Latin American Society of Cryosurgery. In Gran Bretagna, Dawber, Shepherd, Sonnex, e Holt hanno condotto le necessarie ricerche cliniche. Turjansky e Stolar [43] a Buenos Aires, hanno raggiunto una grande esperienza clinica e hanno pubblicato un libro in lingua spagnola sulla criochirurgia. In Portogallo, Goncalves ha mostrato il valore della gestione criochirurgica per i tumori di grandi dimensioni e inoperabili. Breitbart, in Germania, ha aperto la strada all'uso degli ultrasuoni per il monitoraggio della criochirurgia.
I nuovi dispositivi pionieristici hanno portato allo sviluppo di diversi modelli di unità criochirurgia [44-46]. Oggi l'unità dominante in uso è il dispositivo portatile contenente azoto liquido, più comunemente usato come spray, e meno spesso con una sonda criogenica, noto anche come contatto terapia. (Figura 1) [47].
Un cambiamento importante nella terapia era l'abbassamento della temperatura di congelamento nella gestione del carcinoma delle cellule basali e squamose [48]. Sebbene la maggior parte delle malattie della pelle sono trattate con il solo controllo del giudizio clinico, la misurazione della temperatura del tessuto con termosensori è una buona pratica per accertare che sono raggiunte le temperature letali nel tessuto bersaglio [4,31,39,48,49]. L'obiettivo fondamentale del trattamento è di raggiungere una temperatura tra i -50°C ai -60°C per tutto il tumore [50]. Le tecniche sviluppate da Torre, Zacarian, e Gage sono essenzialmente le stesse oggi in uso.
Possiamo quindi affermare che la criochirurgia dermatologica è stata accettata come pratica clinica e il numero di medici che la utilizzano è costantemente in aumento. Più di cinquanta tipi di lesioni benigne e dermatosi sono considerate suscettibili di criochirurgia, tra cui ad esempio diverse condizioni come l'acne cistica, cromomicosi, dermatofibroma, leishmaniosi, mollusco contagioso, cisti mixoide, venosa lago, verruche periungueali, e altri [3]. Le lesioni premaligne quali la cheratosi attinica, la lentigo maligna, la malattia di Bowen, la cheratoacantoma e la cheilite attinica sono trattate in modo ricorrente [43, 51,52].

 Riprendiamo l’intervento (fig.2) la cui descrizione è stata pubblicata nel gennaio del 2006 [53].
Riprendiamo l’intervento (fig.2) la cui descrizione è stata pubblicata nel gennaio del 2006 [53].Menzioniamo il caso clinico di un soggetto donna di 101 anni. Paziente con melanoma avanzato maligno della pelle del viso. Questo esempio è segnalato al fine di valutare la fattibilità e la tollerabilità della tecnica utilizzata, nonché le implicazioni biologiche che il trattamento criochirurgico ottiene in questa neoplasia specifica.
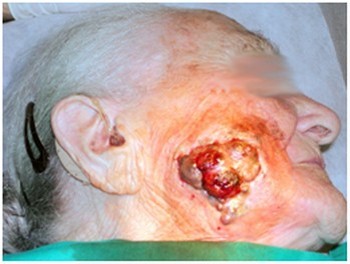 Il trattamento è stato realizzato per mezzo di applicazioni criochirurgiche seriali che sono state conseguite nell’arco di tre mesi (fig. 3,4,5). La massa della lesione ha subito un trattamento con una criosonda ad azoto liquido mentre la malattia residua con criosonda a protossido d'azoto, mediante la tecnica d’inserimento.
Il trattamento è stato realizzato per mezzo di applicazioni criochirurgiche seriali che sono state conseguite nell’arco di tre mesi (fig. 3,4,5). La massa della lesione ha subito un trattamento con una criosonda ad azoto liquido mentre la malattia residua con criosonda a protossido d'azoto, mediante la tecnica d’inserimento.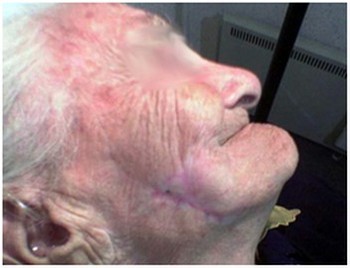
REFERENZE | |
1 | Torre D. New York, cradle of cryosurgery. N Y State J Med 1967;67:465 7. |
2 | Hanke CW & Bailin PL. Current trends in the practice of dermatologic surgery. J Dermatol Surg Oncol 1990;16:130 31. |
3 | Kuflik EG. Cryosurgery updated. J Am Acad Dermatol 1994;31:925 44. |
4 | Farrant J & Walter CA. The cryobiological basis for cryosurgery. J. Dermatol Surg Oncol 1977;3:403 7. |
5 | Lortat-Jacobs L & Solente G. La cryotherapie. Paris: Masson et Cie, 1930. |
6 | White AC. Liquid air: its application in medicine and surgery. Med Rec 1899;56:109 12. |
7 | Whitehouse H. Liquid air in dermatology: its indications and limitations. JAMA 1907;49:371 7. |
8 | Bowen JT & Towle HP. Liquid air in dermatology. Boston Med Surg J 1907;157:561 4. |
9 | Gold J. Liquid air and carbonic acid snow: therapeutic results obtained by dermatologists. N Y Med J 1910;92:1276 7. |
10 | Pusey W. The sue of carbon dioxide snow in the treatment of nevi and other lesions of the skin. JAMA 1907;49:1354 6. |
11 | Low RC. Carbonic acid and snow as a therapeutic agent in the treatment of diseases of the skin. New York: William Wood, 1911. |
12 | Carpenter CC. Cryotherapy for common skin diseases. J Med Soc N J 1943;40:354 7. |
13 | Poppe J. The use of cold air blast in precancerous skin lesions and haemangiomas. Surgery 1942;11:460 65. |
14 | Allington H. Liquid nitrogen in the treatment of skin diseases. Calif Med 1950;72:153 5. |
15 | Kurtin A. Corrective surgical planning of skin. Arch Dermatol 1953;68:389 97. |
16 | Strauss JS & Kligman AM. Acne: observations on dermabrasion and anatomy of pit. Arch Dermatol 1956;74:397 404. |
17 | Wilson JW, Ayeres S, Luikart R, Sternberg AS. Fluorinated hydrocarbon compounds (“Freon”) as a refrigerant in surgical planing. J Invest Dermatol 1955;25:77 80. |
18 | Zacarian SA. Cryosurgery of skin cancer and cryogenic techniques in dermatology. Springfield, IL: Charles C. Thomas, 1969:71. |
19 | Hall A. Advantages and limitations of liquid nitrogen in the therapy of skin lesions. Arch Dermatol 1960;82:63 70. |
20 | Grimmett R. Liquid nitrogen therapy. Histologic observations. Arch Dermatol 1961;83:563 7. |
21 | Zacarian S & Adham M. Cryotherapy of cutaneous malignancy. Cryobiology 1966;2:212 8. |
22 | Zacarian S & Adham M. Cryotherapy temperature studies of human skin. Temperature recordings at two millimeter human skin depth following application with liquid nitrogen. Cryobiology 1967;48:7 10. |
23 | Cooper IS & Lee A. Cryostatic congelation: a system for producing a limited controlled region of cooling or freezing of biologic tissues. J Nerv Ment Dis 1961;133:259 63. |
24 | Cooper IS. Cryostatic cooling and freezing of the basal ganglia. Confin Neurol 1962;22:336 40. |
25 | Cooper IS & Steller S. Cryostatic freezing of brain tumors for excision or destruction in situ. J Neurosurg 1963;20:921 8. |
26 | Kelman CD & Cooper IS. Cryosurgery of retinal detachment and other ocular conditions. Eye Ear Nose Throat Monthly 1963;42:426. |
27 | Cooper IS. A new method of destruction or expiration of benign or malignant tumors. N Engl J Med 1963;268:743 9. |
28 | Cooper IS. Cryogenic surgery for cancer. Fed Proc 1965;24:237 40. |
29 | Cooper IS & Hirose T. Application of cryogenic surgery to resection of parenchymal organs. N Engl J Med 1966;274:15 8. |
30 | Gage AA. In memoriam. Irving S. Cooper, M.D. 1922–1985. Cryobiology 1986;23:287 9. |
31 | Torre D, Lubritz RR, Kuflik EG. Practical cutaneous cryosurgery. Norwalk, CT: Appleton & Lange, 1988. |
32 | Zacarian SA. Cryosurgery of malignant epitheliomas of the skin. In: RandR, RinfretA, Von LeydenH, eds. Cryosurgery. Springfield, IL: Charles C. Thomas, 1968:366 75. |
33 | Zacarian SA. Cryosurgery of tumors of the skin and oral cavity. Springfield, IL: Charles C. Thomas, 1973. |
34 | Zacarian SA. Cryosurgical advances in dermatology and tumors of the head and neck. Springfield, IL: Charles C. Thomas, 1977. |
35 | Gage A, Koepf D, Wehrle D, et al. Cryotherapy for cancer of the lip and oral cavity. Cancer 1965;18:1646 51. |
36 | Gage A. Cryotherapy for inoperable rectal cancer. Dis Colon Rectum 1968;11:36 44. |
37 | Kuflik EG & Gage AA. Cryosurgical treatment for skin cancer. New York: Igaku-Shoin, 1990. |
38 | Kuflik AS & Schwartz RA. Lymphocytoma cutis: a series of five patients successfully treated with cryosurgery. J Am Acad Dermatol1992;26:449 52. |
39 | Kuflik EG. Erosive adenomatosis of the nipple treated with cryosurgery. J Am Acad Dermatol 1998;38:270 71. |
40 | Kuflik EG & Webb W. Effects of systemic corticosteroids on post-cryosurgical edema and other manifestations of the inflammatory response. J Dermatol Surg Oncol 1985;11:464 8. |
41 | Graham GF. Cryosurgery in treatment of acne and specific cutaneous neoplasia. In: ZacarianSA, ed. Cryosurgical advances in dermatology and tumors of the head and neck. Springfield, IL: Charles C. Thomas, 1977:74 80. |
42 | Lubritz RR & Smolewski SA. Cryosurgery cure rate of actinic keratoses. J Am Acad Dermatol 1982;7:631 2. |
43 | Turjansky E & Stolar E. Lesiones de piel y mucosas tecnicas terapeuticas. Buenos Aires: Edama, 1995. |
44 | Tromovitch TA. An intermediate cryosurgical unit: the TT32. Cutis 1975;16:502 3. |
45 | Waller JD, Sandlin FM, Limmer BL. General purpose cryosurgical units. The WSL Nitrosprays I and II. Cutis 1977;20:416 9. |
46 | Lubritz R. Cryosurgery for benign and malignant skin lesions: treatment with a new instrument. South Med J 1976;69:1401 5. |
47 | Kuflik EG. Treatment of basal cell carcinoma with the open-spray technique. J Dermatol Surg Oncol 1986;12:125 6. |
48 | Gage AA. What temperature is lethal for cells? J Dermatol Surg Oncol 1979;5:459 64. |
49 | Kuflik EG. Monitoring treatment with tissue temperature measurement. J Dermatol Surg Oncol 1986;12:925 6. |
50 | Torre D. Cryosurgery of basal cell carcinoma. J Am Acad Dermatol 1986;15:917 29. |
51 | Kuflik EG & Gage AA. Cryosurgery for lentigo maligna. J Am Acad Dermatol 1994;31:75 8. |
52 | Lubritz RR & Smolewski SA. Cryosurgery cure rate of premalignant leukoplakia of the lower lip. J Dermatol Surg Oncol 1983;9:2357. |
53 | Scala M., Gippone M., Queirolo P., et al. Cryosurgery for advanced malignant melanoma of the facial skin. A case of report. In Vivo 2006; 20: 153 – 156. |
54 | Lise M: Surgical decisions in elderly cancer patients. Tumori 2002; 88 (S): S51-52. |
55 | Scala M, Margarino G, Mereu P, Gipponi M: Cryosurgery in oral disease. In “Basics of Cryosurgery. |
56 | Scala M, Gipponi M, Comandini D, Franzone P, Fabiani P, Del Bello A: Cryosurgery alone or in combination with radiotherapy and hyperthermia in the treatment of head and neck mucosal and cutaneous melanoma. J Exp Clin Cancer Res 1994; 13: 243-6. |
57 | Tanaka S: Cryosurgery for malignant melanoma. In “Basics of Cryosurgery. Korpan NN (Ed); Sprinter-Verlag, Vien, 2001: 289-93. |
58 | Collins P, Rogers S, Goggin M, Manning W: Cryotherapy for lentigo maligna. Clin Exp Dermatol 1991; 16: 433-5 |
59 | McKenna DB, Cooper EJ, Kavanagh GM, Davie RM, McLaren KM, Tidman MJ: Amelanotic malignant melanoma following cryosurgery for atypical lentigo maligna. Clin Exp Dermatol 2000; 25: 600-4. |
60 | Korpan NN (Ed); Sprinter-Verlag, Vien, 2001: 285-8. |
Un grazie particolare al chirurgo Davide Marenco | |





